SPECJALISTA RADZI
Pozyskiwanie koncentratu fibryny bogatopłytkowej
Ostatnio usłyszałam na wykładzie o koncentracie fibryny bogatopłytkowej A-PRF,który ma znacznie przyspieszać gojenie tkanek po zabiegach chirurgicznych w obrębie jamy ustnej. Jak można go pozyskać? Czy do pozyskania koncentratu jest potrzebne jakieś specjalne urządzenie?
A-PRF wzbudza duże zainteresowanie wśród stomatologów ze względu na swoje właściwości. W stomatologii ma zastosowanie po zabiegach w chirurgii stomatologicznej i szczękowo-twarzowej, w implantologii, w periodontologii, endodoncji regeneracyjnej i w stomatologii dziecięcej. Ponadto jest wykorzystywany w zabiegach z zakresu medycyny estetycznej.
Ma bezpośredni wpływ na przyspieszone gojenie rany poprzez nasycenie uszkodzonej tkanki, wieloma różnorodnymi czynnikami wzrostu, które wspomagają i przyśpieszają odtworzenie uszkodzonych struktur.
Proces gojenia się np. zębodołu poekstrakcyjnego przebiega zgodnie z trzema fazami zapalenia i opiera się na wytworzeniu skrzepu, w którym fibryna stanowi rusztowanie dla nowo powstającej tkanki kostnej (3).
Pierwsza faza gojenia (faza wysiękowa) trwa od trzech do pięciu dni i jest ostrą reakcją organizmu na uraz, który przewyższa możliwości adaptacji organizmu. Krew jest tu wektorem, który przenosi komórki zapalne i czynniki wzrostu oraz cytokiny do miejsca urazu. Szczególną rolę odgrywają tu płytki krwi i fibrynogen, który zmienia się w fibrynę. W tym czasie dochodzi do oczyszczania się rany.
W drugiej fazie gojenia (fazie proliferacyjnej) dochodzi do stopniowego rozplemu fibroblastów i komórek śródbłonka. Rana wypełnia się tkanką ziarninową oraz luźną tkanką łączną. Faza proliferacyjna łagodnie przechodzi w fazę bliznowacenia po około 14 dniach od urazu (ekstrakcji zęba lub innego zabiegu chirurgicznego).
Ostatnią fazą zapalenia jest faza przebudowy (bliznowacenia), która rozpoczyna się około 14 dnia i trwa indywidualnie u każdego pacjenta. Najczęściej dwadzieścia jeden dni po urazie zębodół pokrywa się dojrzałym nabłonkiem wielowarstwowym płaskim i zbitą tkanką łączną z licznymi włóknami kolagenowymi (3).
Przedstawiony powyżej mechanizm gojenia, np. zębodołu poekstrakcyjnego można przyśpieszyć i zintensyfikować przez zastosowanie koncentratu fibryny bogatopłytkowej.
A-PRF (advanced platelet-rich fibryn) zawiera skoncentrowane czynniki wzrostu, takie jak:
- PDGF – płytkopochodny czynnik wzrostu (platelet-derived growth factor) – jeden z czynników wzrostu, czyli białek regulujących różnicowanie i podziały komórki; odgrywa istotną rolę w angiogenezie,
- TGF-βeta – transformujący czynnik wzrostu βeta, TGF-β ( transforming growth factor β) -białko, które kontroluje proliferację oraz różnicowanie komórek, wykazuje działanie przeciwzapalne,
- IGF – insulinopodobny czynnik wzrostu (insulin-like growth factor),
- TNF – alfa- czynnik martwicy nowotworów α (tumor necrosis factor α),
- VEGF – czynnik wzrostu śródbłonka naczyniowego (vascular endothelial growth factor) – czynnik wzrostu biorący udział w tworzeniu sieci naczyń krwionośnych,
- BMP – białka morfogenetyczne kości (bone morphogenetic protein) – białka z grupy cytokin znane jako czynniki wzrostu, biorą udział w regulacji wzrostu i różnicowania osteoblastów i chondroblastów, indukują tworzenie kości (1, 2, 4).


Ryc. 1. i 1a. Probówka o pojemności 10 ml.


Ryc. 2. i 2a. Zestaw do próżniowego pobierania krwi z igłą motylkową.


Ryc. 3. Przykładowa wirówka laboratoryjna Ryc. 4. Probówka z zestawem motylkowym
ze stojakiem na probówki i kasetą do próżniowego pobierania krwi żylnej. do uzyskania A-PRF.
Do odwirowania osocza używa się wirówki laboratoryjnej (ryc. 3). Obecnie na rynku dostępnych jest bardzo wiele modeli tego urządzenia. Producenci sugerują odpowiednie parametry ustawienia urządzenia w celu uzyskania oczekiwanej frakcji A-PRF. Najczęściej jest to zależne od kąta ustawienia probówek w wirówce, działającej siły odśrodkowej, szybkości i czasu wirowania (5, 6, 7).
Probówki umieszcza się w wirówce zawsze parzyście wraz z przeciwwagą. Po zakończeniu zaprogramowanego procesu wirówka otworzy się samoistnie. Wówczas potrzebny będzie stojak na probówki po odwirowaniu krwi (ryc. 3, 6) oraz zestaw w postaci kasety metalowej i boksu do A-PRF (ryc. 3, 7, 8). Po odwirowaniu probówek należy je umieścić w stojaku, wcześniej zdejmując korek. Po upływie około 5 minut w górnej części powinna wytworzyć się fibryna.
W probówce znajdują się następujące warstwy, zaczynając od dna:
- warstwa erytrocytów
- warstwa przejściowa, buffy coat, znany jako kożuszek leukocytarno-płytkowy, który zawiera najwięcej płytek i leukocytów
- fibryna osocza bogatopłytkowego.
Dalsze postępowanie polega na delikatnym przytrzymaniu za pomocą sterylnej pęsety górnej części „skrzepu” i dolnym uniesieniu skrzepu do góry. (ryc. 7). Następnie należy sterylnymi nożyczkami odciąć skośnie pod kątem jasną część fibryny bogatopłytkowej od warstwy erytrocytów (ryc. 8) i ułożyć w boksie do A-PRF (ryc. 3, 7, 8). W zależności od wskazań formuje się błonę (ryc. 8) lub korek. Otrzymana w ten sposób zaawansowana fibryna jest gotowa do użycia. Można też połączyć rozdrobniony fragment fibryny bogatopłytkowej z materiałem kościozastępczym (stickybone) lub zębem procesowanym (stockytooth).
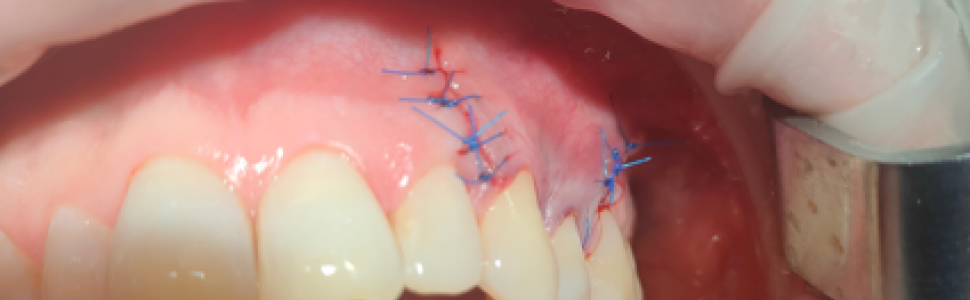
Przy zastosowaniu fibryny po ekstrakcji zęba umieszcza się ją w miejscu biorczym np. w zębodole poekstrakcyjnym, szczelnie go wypełniając. Jeżeli dodatkowo stosuje się błonę z A-PRF, to układa się ją na korku z A-PRF i przykrywa płatem śluzówkowo-dziąsłowym, zaszywając go atraumatycznie.


Ryc. 5. Probówki umieszczone w Ryc. 6. Stojak na probówki z wytrąconą fibryną
wirówce laboratoryjnej. bogatopłytkową


Ryc. 7.Widoczna fibryna bogatopłytkowa Ryc. 8. Uzyskana błona z A-PRF na kasecie metalowej.
uchwycona pęsetą.
- błony – służy do pokrywania uprzednio wprowadzonego materiału augmentacyjnego; jest też nośnikiem fibroblastów i ma zastosowanie do pokrycia recesji – ta forma A-PRF może mieć zastosowanie przy perforacji błony Schneidera, w zabiegach podniesienia zatoki metodą otwartą lub zamkniętą (ryc. 8),
- korka – może być wprowadzony do zębodołu poekstrakcyjnego,
- rozdrobnionej, pociętej – wykorzystuje się go do zmieszania z materiałem kostnym własnym lub kościozastępczym pochodzenia odzwierzęcego (stickybone, stockytooth).
- przyśpieszone gojenia tkanek miękkich i tkanki kostnej przez działanie proosteoindukcyjne,
- inicjację i intensyfikację angiogenezy, czyli przyrostu nowych naczyń krwionośnych,
- zmniejszenie ryzyka zakażenia w obrębie miejsca zabiegu,
- zmniejszenie dolegliwości bólowych, co z pewnością przekona pacjentów do skorzystania z takiej możliwości leczenia.

Ryc. 9. Obraz CBCT okolicy pozostawionego korzenia zęba 24 przed zabiegiem chirurgicznym.


Ryc. 10. Umieszczanie korka z fibryny Ryc. 11. Rana zszyta po zabiegu chirurgicznym
bogatopłytkowej A-PRF w okolicy zębów 23-26.
zębodole poekstrakcyjnym.

Ryc.12. Zdjęcie zębowe wewnątrzustne okolicy 24 po zabiegu i po zastosowaniu A-PRF.
1. Kobayashi E, Flückiger L, Fujioka-Kobayashi M i wsp. Comparative release of growth factors from PRP, PRF, and advanced-PRF. Clin Oral Investig. 2016, 20(9):2353-2360.
2. Schär MO, Diaz-Romero J, Kohl S i wsp. Platelet-rich concentrates differentially release growth factors and induce cell migration in vitro. Clin Orthop Relat Res. 2015, 473(5):1635-43.
3. Fan Y, Perez K, Dym H. Clinical Uses of Platelet-Rich Fibrin in Oral and Maxillofacial Surgery. Dent Clin North Am. 2020, 64(2):291-303.
4. Vitenson J, Starch-Jensen T, Bruun NH, Larsen MK. The use of advanced platelet-rich fibrin after surgical removal of mandibular third molars: a systematic review and meta-analysis. Int J Oral Maxillofac Surg. 2022, 51(7):962-974.
5. Fujioka-Kobayashi M, Miron RJ, Hernandez M i wsp. Optimized Platelet-Rich Fibrin With the Low-Speed Concept: Growth Factor Release, Biocompatibility, and Cellular Response. J Periodontol. 2017, 88(1):112-121.
6. El Bagdadi K, Kubesch A, Yu X i wsp. Reduction of relative centrifugal forces increases growth factor release
within solid platelet-rich-fibrin (PRF)-based matrices: a proof of concept of LSCC (low speed centrifugation concept). Eur J Trauma Emerg Surg. 2019, 45(3):467-479.
7. Choukroun J, Ghanaati S. Reduction of relative centrifugation force within injectable platelet-rich-fibrin (PRF) concentrates advances patients' own inflammatory cells, platelets and growth factors: the first introduction to the low speed centrifugation concept. Eur J Trauma Emerg Surg. 2018, 44(1):87-95.
8. Ghanaati S, Booms P, Orlowska A i wsp. Advanced platelet-rich fibrin: a new concept for cell-based tissue engineering by means of inflammatory cells. J Oral Implantol. 2014, 40(6):679-89.
9. Costa MDMA, Paranhos LR, de Almeida VL, Oliveira LM, Vieira WA, Dechichi P. Do blood concentrates influence inflammatory signs and symptoms after mandibular third molar surgery? A systematic review and network meta-analysis of randomized clinical trials. Clin Oral Investig. 2023, 27(12):7045-7078.
10. Shrivastava R, Ladda R, Patadiya MMM i wsp. Effect of Advanced Platelet-Rich Fibrin and Concentrated Growth Factor on Tissues Around Implants in the Maxillary Anterior Region. J Pharm Bioallied Sci. 2024, 16 (Suppl 3):S2191-S2193.
11. Jamalpour MR, Shahabi S, Baghestani M i wsp. Complementarity of surgical therapy, photobiomodulation, A-PRF and L-PRF for management of medication-related osteonecrosis of the jaw (MRONJ): an animal study. BMC Oral Health. 2022, 18;22(1):241.
12. Matsumura-Matsuo M, To M, Okudera T, Matsuo M. Regeneration processes of alveolar bone and microvascular changes after the application of platelet-rich fibrin. J Oral Biosci. 2023, 65(3):218-225.
13. Kosmidis K, Ehsan K, Pitzurra L i wsp. An in vitro study into three different PRF preparations for osteogenesis potential. J Periodontal Res., 2023, 58(3):483-492.